 La production de protéines recombinantes par les méthodes de génie génétique est un procédé usuel dans la plupart des secteurs de la biotechnologie. Faisant appel à des méthodes parfaitement maîtrisées, ce procédé permet l’obtention de protéines spécifiques, notamment d’intérêt thérapeutique, avec un très haut rendement.
La production de protéines recombinantes par les méthodes de génie génétique est un procédé usuel dans la plupart des secteurs de la biotechnologie. Faisant appel à des méthodes parfaitement maîtrisées, ce procédé permet l’obtention de protéines spécifiques, notamment d’intérêt thérapeutique, avec un très haut rendement.
Des bactéries de la souche Escherichia coli sont transformées grâce à un vecteur plasmidique qui exprime la GFP (green fluorescent protein), dont le gène a été initialement isolé à partir de la méduse Aequorea victoria, ainsi qu’un gène de résistance à l’ampicilline. Une fois transformées, les bactéries sont sélectionnées sur un milieu contenant l’antibiotique. Induite par une molécule activatrice, l’expression du gène de la GFP se traduit par une fluorescence verte observable au niveau des colonies bactériennes.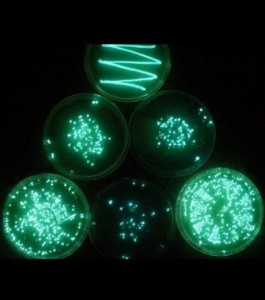
Cet atelier permet d’illustrer la fonction moléculaire des gènes , la modification du génotype de la bactérie par le transgène GFP induit un phénotype particulier, observable à l’œil nu. Mais surtout, il éclaire de manière simple, rapide et convaincante la technique de transgénèse telle qu’elle est employée pour la production de protéines recombinantes.
Une extension de l’atelier est proposée. Elle consiste d’une part à purifier la GFP par chromatographie sur billes de nickel à partir des cultures de bactéries transgéniques. La démarche permet de montrer qu’il est très facile de purifier une protéine recombinante. D’autre part, la GFP est isolée et caractérisée par électrophorèse en gel d’acrylamide, en conditions dénaturantes ou non.
Durée : 2 heures ; 6 heures avec extension.
Niveau : études secondaires (1ère – terminale) ; études supérieures.
Thèmes abordés : Transgénèse ; génotype et phénotype ; protéine recombinante ; génie génétique.

